大肠杆菌载体 E.coli Vector 大肠杆菌宿主菌株 E.coli 细菌广宿主载体 bacateria broad range host vector 链霉菌载体及菌株 Streptomyces 芽孢杆菌载体 Bacillus vector 芽孢杆菌宿主菌株 乳酸菌载体 lactic acid bacteria vector 乳酸菌宿主菌株 lactic acid bacteria strain 细菌基因敲除载体 毕赤酵母载体 毕赤酵母宿主菌株 酿酒酵母载体 酿酒酵母宿主菌株 丝状真菌载体 mold/fungi vector 乳酸克鲁维酵母载体 酵母真菌基因敲除基因编辑载体 植物细胞载体 plant cell vector 农杆菌菌株Agrobacterium tumefaciens strain 植物细胞基因敲除载体 plant cell 哺乳动物细胞载体 哺乳动物细胞荧光载体 荧光素酶报告基因载体 哺乳动物细胞基因敲除基因编辑载体 杂交系统 慢病毒载体 腺病毒载体 逆转录病毒载体 杆状病毒表达载体 基因干扰 RNAi载体 基因/cDNA/ORF 转座子质粒系统 transposon 金黄色葡萄球菌载体 staphylococcus aureus 假单胞菌载体 噬菌体 phage 不动杆菌载体 双岐杆菌载体 藻类表达载体 链球菌载体 厌氧菌载体 基因治疗载体 大肠杆菌基因突变体菌株 细菌荧光质粒 白色念珠菌载体 体外转录载体 谷氨酸棒杆菌载体 酿酒酵母基因突变体菌株 线虫载体 斑马鱼载体 Zebra fish 果蝇,昆虫载体Drosophila 鱼类细胞载体 fish cell 分支杆菌载体 克雷伯菌 枯草芽孢杆菌基因缺失突变株 基因ORF 金黄色葡萄球菌基因敲除突变株 肺炎克雷伯菌基因敲除突变株
| 产品编号 | 产品名称 |
| 芽孢杆菌基因编辑操作体系的综述 |
一、引言
芽孢杆菌是一类广泛存在于土壤和动物胃肠道的革兰氏阳性菌,在饲料行业中被作为重要的益生菌和饲用酶制剂产生菌而广泛的使用。目前工业上很多重要饲用酶制剂,如中温α-淀粉酶、蛋白酶、β-糖苷酶等都是通过芽孢杆菌生产的。近年来,随着分子生物学技术和基因工程技术的发展,以芽孢杆菌作为基因工程宿主菌生产饲用酶、饲用活性代谢产物逐渐成为研究热点。利用现代基因工程技术改造芽孢杆菌,实现饲用酶的高表达、维生素等次级代谢产物的积累,可有效缓解当前畜牧业生产中饲料资源不足、提高养分利用效率,并减少污染排放。芽孢杆菌的基因工程展现出广阔的应用前景。
枯草芽孢杆菌表达系统在载体工具、宿主细胞、转化方法等方面已形成了一套完整的体系,是至今为止发展最成熟最完善的芽孢杆菌表达系统。然而,以枯草芽孢杆菌168及其衍生菌发展起来的表达系统虽然易于操作但是并不能满足工业化大生产的需求。工业上很多重要的饲用酶制剂往往都是由枯草芽孢杆菌以外的一些芽孢杆菌,如地衣芽孢杆菌、嗜碱芽孢杆菌或者解淀粉芽孢杆菌等生产的。这些菌株一般都是上世纪经过诱变选育获得的高产菌株,往往具有比枯草芽孢杆菌更强的蛋白分泌能力。利用基因工程手段对这些高产菌株进行遗传改造,不仅可以在现有基础上进一步提高菌株的产酶活力,而且可以利用其成熟的发酵条件实现其他外源蛋白的高效分泌表达。
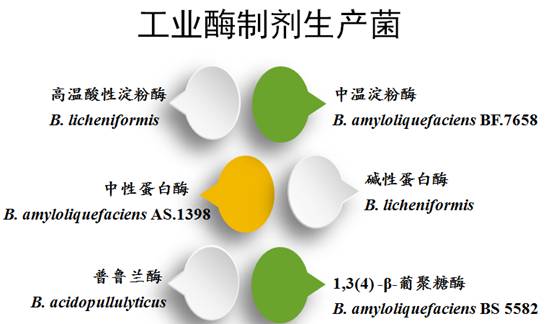
二、解淀粉芽孢杆菌表达体系的建立及工业菌株的遗传改造
该研究以中国农业科学院微生物研究室课题组筛选的一株高产中性蛋白酶野生型菌株K11以及两株工业生产菌株—中性蛋白酶工业生产菌株AS.1398和中温淀粉酶工业生产菌株BF.7658为始发材料进行研究。通过菌种鉴定分析,确定这三株菌株同是属于解淀粉芽孢杆菌。通过基因工程手段对这三株解淀粉芽孢杆菌菌株进行遗传改造,首先需要建立相应的适合这些菌株的遗传操作体系,从而使得在分子水平上对一些关键基因的操控得以完成和实现。然而,解淀粉芽孢杆菌中存在的限制修饰系统、质粒稳定性差、以及内源蛋白酶活力高等一系列问题严重减缓了解淀粉芽孢杆菌作为基因工程宿主菌的发展进程。要建立一个稳定高效的解淀粉芽孢杆菌遗传操作体系,需要从以下几个方面入手研究:
(1)简便快捷、易于操作的遗传转化方法的建立
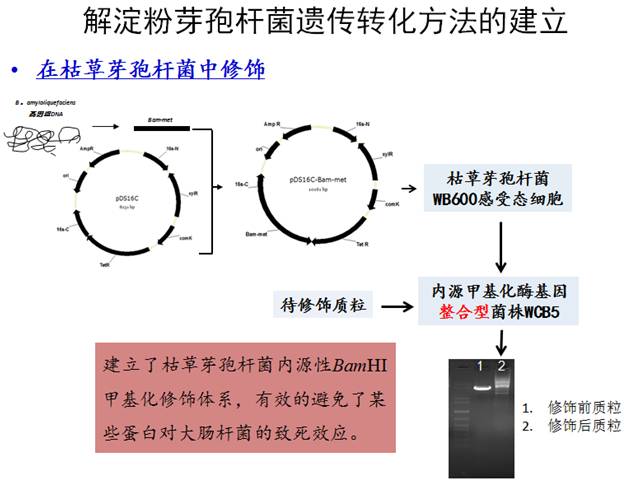
可以用于解淀粉芽孢杆菌转化的方法主要有:自然转化法、原生质体转化法、电穿孔转化法等。目前大多数对解淀粉芽孢杆菌的转化是通过电转化法实现的,该方法不受菌株基因型的限制,但需要针对不同的菌株尤其是工业生产菌株进行培养条件及电转化参数的调整,才能获得较高的转化效率。1999年,有研究表明通过在生长培养基、洗涤培养基以及复苏培养基中加入不同浓度的甘露醇和山梨醇作为渗透压保护剂,可以使得枯草芽孢杆菌的电转化效率达到1.4×106转化子/μgDNA,该转化方法的建立成为了革兰氏阳性菌电转化法的一个里程碑。此后对解淀粉芽孢杆菌的转化方法都是在此方法的基础上改进或通过添加不同的细胞壁弱化剂而建立的。2010年,国外有研究报道通过在对数生长期的细胞中添加细胞壁弱化剂甘氨酸,建立了解淀粉芽孢杆菌的电转化方法,并依此完善了解淀粉芽孢杆菌无抗性标记基因的基因敲除方法。2011年,有研究通过在培养基中添加细胞壁弱化剂DL-苏氨酸或甘氨酸,进一步提高了解淀粉芽孢杆菌TA208电转化法的效率。这些对芽孢杆菌转化方法的研究中所使用的质粒均是从解淀粉芽孢杆菌中提取出的经同源甲基化修饰的质粒。
而在实际研究过程中,用于转化解淀粉芽孢杆菌的质粒均是从E.coli或者B.subtilis中提取出来的,这些外源DNA用于解淀粉芽孢杆菌的转化时往往会被其自身的限制性修饰系统所降解,这也是运用基因工程手段对解淀粉芽孢杆菌进行遗传操作过程中亟待解决的其中一个难点问题。对于研究型实验菌株而言,可将菌株自身存在的限制修饰系统敲除,以便于遗传操作。然而对于工业生产菌株来说为了保持其在长期发酵生产中的相对遗传稳定性,不能将其存在的限制修饰系统敲除。针对这一难题,研究者做了大量的研究工作,也取得了一些突破性的进展。早期有报道去除BamHI识别序列GGATCC的衍生型质粒可用于转化解淀粉芽孢杆菌,但转化率非常低,只有1-2个转化子/10 μgDNA。目前较常用的方法是从敲除Dam和Dcm甲基化酶的E.coli JM110菌株中提取无Dam和Dcm甲基化的质粒,再用商业化的BamHI甲基化酶处理质粒后进行解淀粉芽孢杆菌的转化。2009年,有文献报道从解淀粉芽孢杆菌Baillus amyloliquefaciensCICIM B2125中克隆了BamHI甲基转移酶基因,并利用其自身启动子在大肠杆菌JM109中表达了具有活性的BamHI甲基转移酶,此报道为解淀粉芽孢杆菌甲基化的研究提供了新的思路,即将Baillus amyloliquefaciens甲基化酶基因先在一个容易转化的宿主,如E. coli或B. subtilis中进行表达,来实现对预转化质粒的体内甲基化处理。2012年,中科院微生物研究所等报道了一种MoDMP模型,即在一株内源限制修饰系统全部缺失的大肠杆菌EC135中,将Bacillus amyloliquefaciens TA208推定的4个具有活性的MTase通过酿酒酵母一步组装法组装至pWYE724中进行共表达,从而使得共表达了MTase的大肠杆菌具有与难转化细菌相似的DNA甲基化模式。通过将质粒转入构建的的大肠杆菌EC135/P.BamHI宿主中进行甲基化预处理,可以有效的提高对于解淀粉芽孢杆菌的转化效率。然而,本研究在对中性蛋白酶的研究过程中发现,芽孢杆菌中性蛋白酶基因自身的启动子对大肠杆菌具有致死效应,这使得以EC135/P.BamHI为模型的修饰体系受到了某种限制。为了更好的解决大肠杆菌致死的问题,本研究将载体的前期构建工作,转移到转化效率较高的枯草芽孢杆菌中进行甲基化的技术方法,避开了大肠杆菌,有效的解决了质粒载体的甲基化修饰和大肠杆菌致死等问题,成功的建立了简便快捷、易于操作的适用于三株菌株的解淀粉芽孢杆菌遗传转化方法。
(2)介导外源基因高效表达且能够稳定遗传的载体工具
外源基因在芽孢杆菌中的高效分泌表达是由高效分泌表达载体介导实现的,而高效分泌表达载体又是由稳定且高拷贝的质粒载体、强的启动子和高效分泌的信号肽等组成的。国内外学者在对枯草芽孢杆菌表达系统的不断研究与完善过程中,发展出了多个成熟的载体系统,如以P43,Pgrac,Pxyl为启动子元件的载体质粒,这些载体工具同样的可以用于解淀粉芽孢杆菌的遗传操作。有文献报道利用枯草芽孢杆菌的Pgrac启动子实现了解淀粉芽孢杆菌来源的果聚糖在其自身宿主中的高效表达。然而,有些研究中利用解淀粉芽孢杆菌BF7658作为宿主菌对普鲁兰酶基因进行异源重组表达时发现,解淀粉芽孢杆菌α-淀粉酶启动子及信号肽(Pamy-SPamy)比枯草芽孢杆菌P43启动子与SacB信号肽(P43-SPsacB)更适合引导普鲁兰酶在解淀粉芽孢杆菌BF. 7658中的重组表达。2016年报道的以PamyQ启动子和P43启动子对Pyrococcus furiosus来源的α-淀粉酶基因在解淀粉芽孢杆菌进行重组表达的研究也证实了解淀粉芽孢杆菌来源的表达元件更适合介导外源基因在其自身宿主中的重组表达。由此看来,表达元件与目标基因以及与受体细胞之间的合理匹配对异源基因在解淀粉芽孢杆菌中的表达起着重要的作用。因此,为了提高外源基因在解淀粉芽孢杆菌中的表达分泌水平,本研究从高产酶蛋白的芽孢杆菌工业生产菌株中,挖掘了适合在解淀粉芽孢杆菌K11中高效表达的强启动子、高效的分泌信号肽等组合表达元件,并利用多种基因对挖掘到的表达元件进行了通用性验证,该研究结果为解淀粉芽孢杆菌表达系统的进一步完善和推广发展起到了积极的推动作用。
重组质粒的不稳定性是限制含高拷贝游离质粒的重组芽孢杆菌在工业生产中广泛应用的重要因素。质粒的不稳定可以分成两大类:(1)分离不稳定性,即在没有选择压力的情况下,由质粒在复制过程中造成的丢失;(2)结构不稳定性,即重组质粒在传代过程中容易发生外源基因的丢失或结构重排从而使得目标蛋白产量减少。在工业应用中,由于不能添加抗生素,重组质粒在工程菌中的稳定性显得尤为重要。本研究在对解淀粉芽孢杆菌菌株的遗传改造研究中发现,如果重组质粒中同时含有大肠杆菌复制元件和芽孢杆菌复制元件时,质粒的稳定性非常差,在没有抗生素选择压力的情况下,转接6次就有90%的重组菌株发生质粒丢失;但是将重组质粒中大肠杆菌复制元件删除后,重组质粒即可稳定复制,无选择压力转接100代仍稳定存在。该研究结果有效的解决了解淀粉芽孢杆菌中重组质粒不稳定的难题,对于解淀粉芽孢稳定高效遗传体系的建立及扩大芽孢杆菌工程菌在工业化上的应用具有重要的意义。
(3)蛋白酶缺失的解淀粉芽孢杆菌宿主细胞
芽孢杆菌在生长后期会向细胞外分泌大量蛋白酶,不利于外源蛋白的积累。通过基因敲除的方式构建蛋白酶缺陷株,可以极大的减小因蛋白酶的降解作用导致的目的蛋白质产率的下降。Wong等(1991)对枯草芽孢杆菌168中的6个蛋白酶基因敲除后,得到了WB600菌株,该菌株在进行异源蛋白表达时有助于目标蛋白的产量的提高,是目前应用最广泛的枯草芽孢杆菌宿主菌之一。解淀粉芽孢杆菌中同样也存在大量的蛋白酶,但是由于以解淀粉芽孢杆菌作为宿主菌的研究并不是很多,研究也不是很深入,目前还没有解淀粉芽孢杆菌蛋白酶缺陷型菌株的相关报道。本研究以中性蛋白酶高产菌株-解淀粉芽孢杆菌K11为研究对象,通过敲除K11菌株中的蛋白酶基因,构建了蛋白酶缺陷型突变株K11(Δnpr)。以蛋白酶缺陷型突变株作为宿主菌时,外源蛋白的表达水平均有不同幅度的提升。

通过以上研究,我们建立了通用性好、稳定性强、分泌量高的解淀粉芽孢杆菌高效表达体系,同时对两株工业生产菌株进行了相应的遗传改造,极大提高了两株菌的分泌产酶水平。本研究不仅为有重要应用价值的饲用酶蛋白的异源高效表达提供新的表达工具,同时也为其他芽孢杆菌表达体系的建立提供理论指导。
三、结论
近年来,随着越来越多的芽孢杆菌基因组测序工作的陆续完成,对芽孢杆菌的研究进入了新的快速发展时期,而其作为基因工程表达系统也将会不断被完善,并展现出良好的应用前景。同时,芽孢杆菌的遗传学操作方法也在不断地更新,快捷高效的方法将会大大提高对多种芽孢杆菌表达系统研究的效率。

